Pcl5 какая связь. Химическая связь
«Основные типы химической связи» - Металлическая связь. Механизмы разрыва ковалентной связи. Электроны. Na+Cl. Ионная химическая связь. Химическая связь. Полярность связи. Параметры ковалентной связи. Насыщаемость. Водородная связь. Механизмы образования ковалентной связи. Свойства ковалентной связи. Виды ковалентной связи. Взаимодействие атомов в химических соединениях.
«Водородная связь» - Водородная связь. 2)между молекулами аммиака. Тема. Высокие температуры. Возникает между молекулами. Факторы, разрушающие водородную связь в белковой молекуле (денатурирующие факторы). 2)некоторые спирты и кислоты неограниченно растворимы в воде. 1)между молекулами воды. Электромагнитное излучение. Внутримолекулярная водородная связь.
«Металлическая химическая связь» - Металлическая связь имеет черты сходства с ковалентной связью. Металлическая химическая связь. Наиболее пластичны золото, медь, серебро. Лучшие проводники медь и серебро. Различия металлической связи с ионной и ковалентной. Металлическая связь - химическая связь, обусловленная наличием относительно свободных электронов.
«Химия «Химическая связь»» - Вещества с ковалентной связью. Параметры ковалентной связи. Ковалентная связь. Ионная связь – это электростатическое притяжение между ионами. Металлы образуют металлические кристаллические решетки. Число общих электронных пар равно числу связей между двумя атомами. Водородная химическая связь. Виды химической связи и типы кристаллических решеток.
«Ковалентная связь» - Способы образования связи. А 3. Химическая связь. В молекуле оксида серы (IV) имеются связи 1) 1б и 1 П 2) 3б и 1 П 3) 4б 4) 2б и 2 П. Степень окисления и валентность химических элементов. Степень окисления равна нулю в соединениях: 1) Ca3P2 2) O3 3) P4O6 4) CaO 12. Высшую степень окисления проявляет в соединении 1) SO3 2) Al2S3 3) H2S 4) NaHSO3 11.
«Химическая связь и её виды» - Полярная связь. Взаимодействие между атомами. Определение понятия. Проверочная работа. Виды химической связи в неорганических веществах. Ковалентная неполярная связь. Характеристика типов связи. Выигрышный путь. Выполните задание. Ионная связь. Параметры характеристики связи. Самостоятельная работа.
Всего в теме 23 презентации
61. Какая химическая связь называется водородной? Приведите три примера соединений с водородной связью. Изобразите структурные схемы приведенных ассоциатов. Как влияет образование водородной связи на свойства веществ (вязкость, температуры кипения и плавления, теплоты плавления и парообразования?
62. Какая связь называется s- и какая - p-связью? Какая из них менее прочная? Изобразите структурные формулы этана C 2 H 6 , этилена C 2 H 4 и ацетилена C 2 H 2 . Отметьте s- и p-связи на структурных схемах углеводородов.
63. В молекулах F 2 , O 2 , H 2 SO 4 , HCl, CO 2 укажите тип связей, число s- и p-связей.
64. Какие силы межмолекулярного взаимодействия называются диполь-дипольными (ориентационными), индукционными и дисперсионными? Объясните природу этих сил. Какова природа преобладающих сил межмолекулярного взаимодействия в каждом из следующих веществ: H 2 O, HBr, Ar, N 2 , NH 3 ?
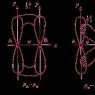
65. Приведите две схемы заполнения МО при образовании донорно-акцепторной связи в системах с атомными заселениями:
а) электронная пара – свободная орбиталь (2+0) и
б) электронная пара – электрон (2+1).
Определите порядок связи, сравните энергии связей. Какая из рассмотренных связей участвует в образовании иона аммония + ?
66. На основании строения атомов в нормальном и возбужденном состояниях определите ковалетность бериллия и углерода в молекулах BeCl 2 , (BeCl 2) n , CO и CO 2 . Изобразите структурные формулы молекул.
67. На основании положений зонной теории кристаллов охарактеризуйте металлы, проводники и диэлектрики. От чего зависит ширина запрещенной зоны? Какие примеси нужно добавить к кремнию, чтобы превратить его в:
а) n-полупроводник; б) р-полупроводник?
68. Приведите электронную конфигурацию молекулы NO по методу МО. Как изменяются магнитные свойства и прочность связи при переходе от молекулы NO к молекулярному иону NO + ?
69. Какая химическая связь называется ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите примеры молекул с типично ионными связями и укажите тип кристаллической решетки. Составьте изоэлектронный ряд ксенона.
70. На основании строения атомов в нормальном и возбужденном состояниях определите ковалентность лития и бора в соединениях: Li 2 Cl 2 , LiF, - , BF 3 .
71. Какая химическая связь называется координационной или донорно-акцепторной? Разберите строение комплекса 2+ . Укажите донор и акцептор. Как метод валентных связей (ВС) объясняет тетраэдрическое строение этого иона?
72. Почему существует молекула PCl 5 , но не существует молекула NCl 5 , хотя азот и фосфор находятся в одной и той же подгруппе VA периодической системы? Какой тип связи между атомами фосфора и хлора? Укажите тип гибридизации атома фосфора в молекуле PCl 5 .
73 Охарактеризуйте типы кристаллических структур по природе частиц узлов решеток. Какие кристаллические структуры имеют: CO 2 , CH 3 COOH, алмаз, графит, NaCl, Zn? Расположите их по порядку возрастания энергий кристаллических решеток. Что такое интеркалирование?
74. Приведите четыре примера молекул и ионов с делокализованными связями. Изобразите их структурные формулы.
75. Какой тип гибридизации в молекулах CCl 4 , H 2 O, NH 3 ? Изобразите в виде схем взаимное расположение гибридных облаков и укажите углы между ними.
76. Приведите две схемы заполнения МО при взаимодействии двух АО с заселениями:
а) электрон + электрон (1+1) и
б) электрон + вакантная орбиталь (1+0).
Определите ковалентность каждого атома и порядок связи. В каких пределах энергия связи? Какие из указанных связей в молекуле водорода H 2 и молекулярном ионе ?
77. Приведите электронную конфигурацию молекулы азота по методу МО. Докажите, почему молекула азота обладает большой энергией диссоциации.
78. Что такое дипольный момент? Как он изменяется в ряду сходно построенных молекул: HCl, HBr, HJ? Какой тип связи осуществляется между атомами водорода, хлора, брома и йода в приведенных молекулах? s - или p-связи в этих молекулах?
79. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа AB n , если связь в них образуется за счет sp-, sp 2 -, sp 3 - гибридизации орбиталей атома A? Приведите примеры молекул с указанными типами гибридизации. Укажите углы между связями.
80. Даны пары веществ: а) H 2 O и CО; б) Вr 2 и CH 4 ; в) CаО и N 2 ; г) H 2 и NH 3 . Для какой пары веществ характерна ковалентная неполярная связь? Изобразите структурные схемы выбранных молекул, укажите формы этих молекул и углы между связями.
Вариант 1
2) укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент;
Укажите положение серы в Периодической таблице. Приведите её электронную формулу.
Выберите из списка вещества, в молекулах которых содержится ковалентная неполярная связь: PCl 5 , CH 4 , H 2 , CO 2 , O 2 , S 8 , SCl 2 , SiH 4 .
2 O, S 2 , NH 3 .
Контрольная работа «Атомы химических элементов»
Вариант 2
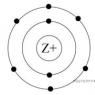
На рисунке изображена модель электронного строения атома некоторого химического элемента.

На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Укажите положение азота в Периодической системе. Приведите его электронную формулу.
Выберите из списка вещества, в молекулах которых содержится ионная связь: NaF , N 2 O 5 , H 2 S , KI , Cu , SO 3 , BaS .
Определите тип химической связи и запишите схемы её образования для веществ: Cl 2 , MgCl 2 , NCl 3 .
Определите для каждого изотопа:
Контрольная работа «Атомы химических элементов»
Вариант 3
На рисунке изображена модель электронного строения атома некоторого химического элемента.

На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Укажите положение алюминия в Периодической системе. Приведите его электронную формулу.
Выберите из списка вещества, в молекулах которых содержится ковалентная полярная связь: O 3 , P 2 O 5 , P 4 , H 2 SO 4 , CsF , HF , HNO 3 , H 2 .
Определите тип химической связи и запишите схемы её образования для веществ: H 2 O, N 2 , Na 3 S.
Определите для каждого изотопа:
Контрольная работа «Атомы химических элементов»
Вариант 4
На рисунке изображена модель электронного строения атома некоторого химического элемента.

На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Укажите положение кислорода в Периодической системе. Приведите его электронную формулу.
3. Вещества только с ионной связью приведены в ряду:
1) F 2 , СС l 4 , КС 1;
2) NaBr, Na 2 O, KI;
3) SO 2 , P 4 , CaF 2 ;
4) H 2 S, Br 2 , K 2 S.
4. Определите тип химической связи и запишите схемы её образования для веществ: CaCl 2 , O 2 , HF.
5. Определите для каждого изотопа:
Контрольная работа «Атомы химических элементов»
Вариант 5
На рисунке изображена модель электронного строения атома некоторого химического элемента.

На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
2. Укажите положение углерода в Периодической системе. Приведите его электронную формулу.
3. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl, NaCl, Cl 2 ;
2) O 2 , H 2 O, CO 2 ;
3) H 2 O, NH 3 , CH 4 ;
4) NaBr, HBr, CO.
4. Определите тип химической связи и запишите схемы её образования для веществ: Li 2 O, S 2 , NH 3 .
5. Определите для каждого изотопа: